Bảng tuần hoàn các nguyên tố hoá học Full HD
Dường như từ khi Dmitri Mendeleev lần đầu tiên sắp xếp các nguyên tố hóa học vào một bảng dạng tuần hoàn vào năm 1869, bảng tuần hoàn các nguyên tố đã trở thành một biểu tượng vĩ đại của sự hiểu biết về cấu trúc và tính chất của vũ trụ.
Bảng tuần hoàn là gì?
Khái niệm bảng tuần hoàn khoá học
Bảng tuần hoàn hay Bảng tuần hoàn hoá học hay Bảng tuần hoàn Mendeleev là bảng liệt kê các nguyên tố hóa học dựa trên số hiệu nguyên tử, cấu hình electron và các tính chất hóa học tuần hoàn của chúng.
Bảng tuần hoàn hoá học thường được gọi là Bảng tuần hoàn Mendeleev, theo tên của nhà hóa học Nga đã công bố bảng tuần hoàn đầu tiên vào năm 1869.
Bảng tuần hoàn được chia thành hàng và cột. Hàng ngang thể hiện các chu kỳ, trong khi cột dọc thể hiện các nhóm hoặc phân loại nguyên tố. Bằng cách này, bảng tuần hoàn cung cấp một cấu trúc hữu ích để hiểu sự liên kết và tính chất của các nguyên tố, cũng như giúp dự đoán các tính chất của các nguyên tố chưa được phát hiện.
Bảng tuần hoàn hoá học là một công trình khoa học vĩ đại của nhà hóa học người Nga Dmitri Mendeleev.
Ông đã công bố bảng tuần hoàn đầu tiên vào năm 1869, dựa trên sự thay đổi tuần hoàn của tính chất hóa học của các nguyên tố theo khối lượng nguyên tử của chúng. Ông đã sắp xếp 63 nguyên tố đã biết vào thời đó theo thứ tự tăng dần của khối lượng nguyên tử, và chia chúng thành các nhóm và chu kỳ có tính chất tương đồng.
Lịch sử bảng tuần hoàn hoá học
Dmitri Mendeleev, một nhà hóa học Nga, được coi là người đầu tiên đã sắp xếp các nguyên tố vào một bảng dạng tuần hoàn vào năm 1869.
Ông cũng đã để lại những chỗ trống trong bảng tuần hoàn để dự đoán sự tồn tại và tính chất của các nguyên tố chưa được phát hiện. Sau đó, nhiều nguyên tố mới đã được tìm thấy và khớp với những dự đoán của ông, chứng minh sự chính xác và tiên phong của bảng tuần hoàn của Mendeleev.
Bảng tuần hoàn của Mendeleev đã được cải tiến và hoàn thiện bởi nhiều nhà khoa học sau này, như Henry Moseley, Glenn Seaborg, và IUPAC. Họ đã sử dụng các tiêu chí khác nhau để sắp xếp các nguyên tố, như số hiệu nguyên tử, cấu hình electron, và số lượng proton. Họ cũng đã bổ sung các nguyên tố mới, như các nguyên tố phóng xạ, các nguyên tố nhân tạo, và các nguyên tố siêu nặng.
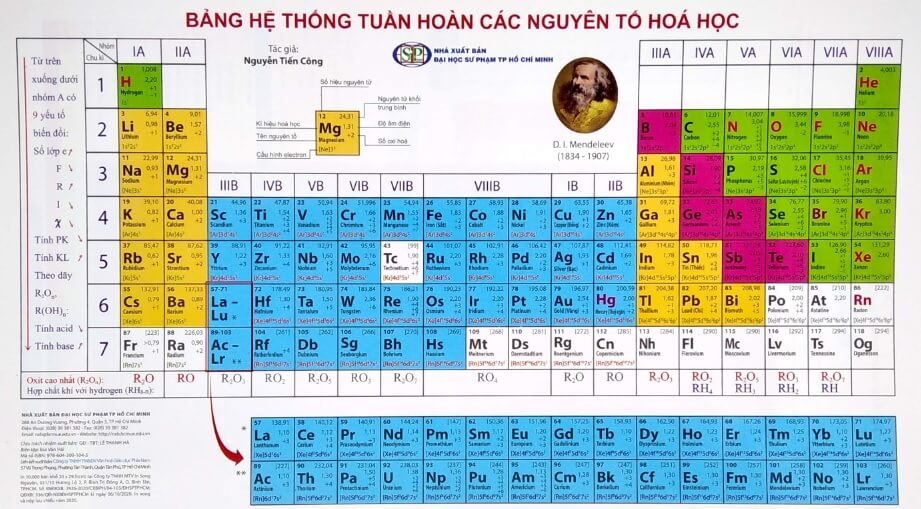
Hiện nay, bảng tuần hoàn hoá học có 118 nguyên tố, được chia thành 18 nhóm và 7 chu kỳ, cùng với một nhóm nguyên tố lanthanide và actinide. Bảng tuần hoàn hoá học là một công cụ quan trọng và hữu ích trong nghiên cứu và ứng dụng các nguyên tố hoá học.
Vai trò và ý nghĩa của bảng tuần hoàn
Bảng tuần hoàn nguyên tố hóa học có ý nghĩa vô cùng quan trọng trong lĩnh vực hóa học. Nó cung cấp cho chúng ta một cách tiện lợi để xác định và so sánh các đặc điểm và tính chất của các nguyên tố.
Thứ nhất: Bảng tuần hoàn giúp phân loại các nguyên tố hóa học theo số hiệu nguyên tử, cấu hình electron và các tính chất hóa học tuần hoàn của chúng. Các nguyên tố có cùng cấu hình electron ở lớp hóa trị sẽ có tính chất hóa học tương đồng và được sắp xếp vào cùng một nhóm. Các nguyên tố có cùng số lớp electron sẽ có cấu trúc electron tương tự và được sắp xếp vào cùng một chu kỳ.
Thứ 2: Bảng tuần hoàn giúp xác định và so sánh các đặc điểm và tính chất của các nguyên tố hóa học, như tính kim loại, tính phi kim, hóa trị, độ âm điện, bán kính nguyên tử, khả năng liên kết, độ phản ứng, v.v. Các tính chất này thường biến đổi theo quy luật tuần hoàn khi di chuyển theo hướng ngang hoặc dọc trong bảng tuần hoàn.
Thứ 3:Bảng tuần hoàn giúp dự đoán sự tồn tại và tính chất của các nguyên tố chưa được phát hiện hoặc chưa được nghiên cứu. Bằng cách để lại những chỗ trống trong bảng tuần hoàn, các nhà khoa học có thể tiên đoán về số hiệu nguyên tử, cấu hình electron, và tính chất hóa học của các nguyên tố mới.
Cấu tạo bảng tuần hoàn các nguyên tố hoá học
Cấu trúc bảng tuần hoàn
- Chu kỳ là một hàng ngang trong bảng tuần hoàn, được đánh số từ 1 đến 7. Các nguyên tố trong cùng một chu kỳ có cùng số lớp electron. Số chu kỳ bằng số lớp electron lớn nhất của nguyên tố. Ví dụ, Carbon có 2 lớp electron, nên nó thuộc chu kỳ 2. Uranium có 7 lớp electron, nên nó thuộc chu kỳ 7.

- Nhóm là một cột dọc trong bảng tuần hoàn, được đánh số từ 1 đến 18. Các nguyên tố trong cùng một nhóm có cùng số electron hóa trị (số electron ở lớp ngoài cùng). Số nhóm bằng số electron hóa trị của nguyên tố, trừ nhóm 0 (nhóm 18) có 8 electron hóa trị. Ví dụ, Natri có 1 electron hóa trị, nên nó thuộc nhóm 1. Oxi có 6 electron hóa trị, nên nó thuộc nhóm 16.
- Khối là một phần của bảng tuần hoàn, được đặt tên theo phân lớp mà electron cuối cùng của nguyên tố điền vào. Có 4 khối chính là khối s, khối p, khối d và khối f. Ví dụ, Magie có electron cuối cùng điền vào phân lớp s, nên nó thuộc khối s. Nhôm có electron cuối cùng điền vào phân lớp p, nên nó thuộc khối p. Sắt có electron cuối cùng điền vào phân lớp d, nên nó thuộc khối d. Ceri có electron cuối cùng điền vào phân lớp f, nên nó thuộc khối f.
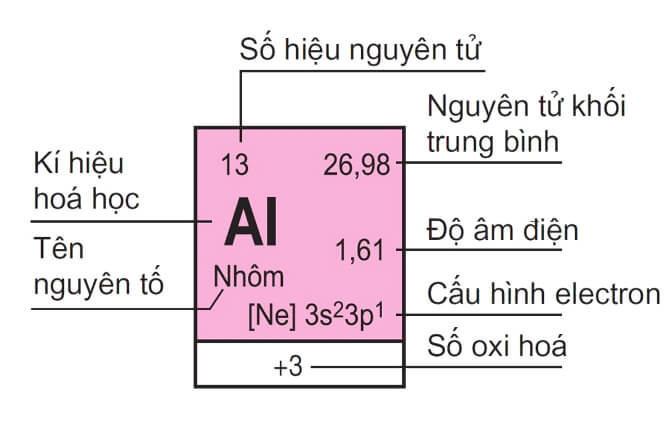
- Ô là một ô vuông nhỏ trong bảng tuần hoàn, chứa thông tin về một nguyên tố hóa học. Mỗi ô thường gồm có tên, ký hiệu, số hiệu nguyên tử và khối lượng nguyên tử của nguyên tố. Ví dụ, ô của Hydro có tên là Hydro, ký hiệu là H, số hiệu nguyên tử là 1 và khối lượng nguyên tử là 1,008.
Phân loại nguyên tố hoá học
Phân loại nguyên tố là một cách chia các nguyên tố hóa học thành các nhóm dựa trên các tính chất vật lý và hóa học của chúng. Có ba nhóm chính là kim loại, phi kim và á kim.
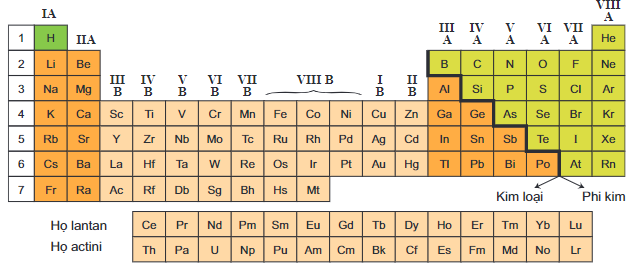
- Kim loại là các nguyên tố có tính chất như dẫn nhiệt và điện tốt, có ánh kim, dễ uốn và dẻo, thường là chất rắn ở nhiệt độ phòng (ngoại trừ thủy ngân là chất lỏng). Kim loại có năng lượng ion hóa thấp, dễ nhường electron và tạo thành ion dương. Kim loại nằm ở phía bên trái và góc dưới bên phải của bảng tuần hoàn. Ví dụ: sắt, đồng, bạc, vàng, v.v.
- Phi kim là các nguyên tố có tính chất ngược lại với kim loại, như dẫn nhiệt và điện kém, không có ánh kim, khó uốn và dẻo, thường là chất khí ở nhiệt độ phòng (một số là chất lỏng hoặc rắn). Phi kim có năng lượng ion hóa cao, dễ thu nhận electron và tạo thành ion âm. Phi kim nằm ở phía trên, bên phải của bảng tuần hoàn. Ví dụ: oxy, nitơ, clo, lưu huỳnh, v.v.
- Á kim là các nguyên tố có tính chất trung gian giữa kim loại và phi kim, có thể dẫn điện hoặc cách điện tùy theo điều kiện môi trường. Á kim là những chất bán dẫn quan trọng trong công nghệ điện tử. Á kim có dạng rắn ở nhiệt độ phòng. Á kim nằm ở góc trên bên phải của bảng tuần hoàn, giữa kim loại và phi kim. Ví dụ: boron, silic, germani, v.v.
Những thuật ngữ cần biết khi đọc bảng tuần hoàn
Bảng tuần hoàn là một công cụ quan trọng trong hóa học, giúp biểu diễn các nguyên tố theo thứ tự tăng dần của số nguyên tử và nhóm hóa trị. Để hiểu được bảng tuần hoàn, bạn cần nắm vững một số thuật ngữ cơ bản, như nguyên tử, proton, nơtron, electron, vỏ electron, nhóm, chu kỳ và khối...
Nguyên tố
Trong hóa học, nguyên tố là một chất hóa học tinh khiết, bao gồm một kiểu nguyên tử, được phân biệt bởi số hiệu nguyên tử, là số lượng proton có trong mỗi hạt nhân. Các nguyên tố hóa học không thể bị phân hủy thành các chất đơn giản hơn bằng các phương pháp hóa học. Có 118 nguyên tố hóa học đã biết, được liệt kê trong bảng tuần hoàn hóa học1
Đồng vị
Đồng vị là các biến thể của một nguyên tố hóa học, trong đó hạt nhân nguyên tử có cùng số proton nhưng khác số neutron. Do đó, chúng có số khối khác nhau. Ví dụ, carbon có ba đồng vị là carbon-12, carbon-13 và carbon-14, với số neutron lần lượt là 6, 7 và 8. Các đồng vị của một nguyên tố có cùng tính chất hóa học nhưng khác nhau về tính chất vật lý và phóng xạ. Có hai loại đồng vị chính là đồng vị bền và đồng vị phóng xạ
Ký hiệu hoá học
Là ký tự viết tắt của tên nguyên tố, thường là chữ cái đầu tiên hoặc hai chữ cái đầu tiên của tên nguyên tố. Ví dụ, H là ký hiệu của Hydro, He là ký hiệu của Heli, v.v.
Số hiệu nguyên tử
Là số proton trong hạt nhân của nguyên tử, cũng là số thứ tự của nguyên tố trên bảng tuần hoàn. Ví dụ, Hydro có số hiệu nguyên tử là 1, Heli là 2, v.v.
Bán kính nguyên tử
Là khoảng cách từ trung tâm của nguyên tử đến lớp electron ngoài cùng của nó, khi nguyên tử ở trạng thái đơn độc hoặc liên kết với các nguyên tử khác. Bán kính nguyên tử được đo bằng đơn vị mét (m) hoặc pikô mét (pm). Ví dụ, bán kính nguyên tử của Hydro là 53 pm, của Heli là 31 pm, v.v.
Điện tích hạt nhân
Là tổng điện tích của các proton trong hạt nhân của nguyên tử, được tính bằng số proton nhân với điện tích của một proton. Điện tích hạt nhân được đo bằng đơn vị Coulomb © hoặc đơn vị lượng tử điện tích (e). Ví dụ, điện tích hạt nhân của Hydro là 1,6022 x 10^-19 C hoặc 1e, của Heli là 3,2044 x 10^-19 C hoặc 2e, v.v.
Năng lượng ion hoá
Là năng lượng cần thiết để tách một electron ra khỏi nguyên tử ở trạng thái khí, tạo thành một ion dương. Năng lượng ion hóa được đo bằng đơn vị Joule (J) hoặc kilô Joul trên mol (kJ/mol). Ví dụ, năng lượng ion hóa của Hydro là 1312 kJ/mol, của Heli là 2372 kJ/mol, v.v.
Độ âm điện
Là khả năng của một nguyên tử thu hút các electron trong liên kết hóa học với các nguyên tử khác. Độ âm điện được đo bằng đơn vị không có chiều, thường là theo thang Pauling. Ví dụ, độ âm điện của Hydro là 2,2, của Heli là 0, v.v.
Hoá trị
Là số liên kết hóa học mà một nguyên tử có thể tạo được với các nguyên tử khác trong một hợp chất. Hoá trị thể hiện khả năng nhường hoặc nhận electron của nguyên tử. Hoá trị được biểu thị bằng số nguyên dương, âm hoặc không. Ví dụ, hoá trị của Hydro là 1, của Oxi là 2, của Nitơ là 3, v.v.
Khối lượng nguyên tử
Là khối lượng trung bình của các đồng vị của một nguyên tố, được tính bằng tổng số proton và neutron trong nguyên tử. Ví dụ, trọng lượng nguyên tử của Hydro là 1,0079, của Heli là 4,0026, v.v.
Ngoài ra còn nhiều thuật ngữ khác bạn cần biết xung quanh các nguyên tố hoá học như: Cấu hình electron, đồng vị bền, đồng vị phóng xạ, bán kính nguyên tử, phân tử hợp chất,... Rất nhiều.
Nguyên tắc sắp xếp trong bảng tuần hoàn các nguyên tố
Trong bảng tuần hoàn, các nguyên tố hóa học được sắp xếp theo ba nguyên tắc chính.
Các nguyên tắc sắp xếp này giúp phân loại các nguyên tố theo cấu trúc điện tử và tính chất hóa học của chúng. Các nguyên tố trong cùng một chu kỳ thường có các tính chất vật lý khác nhau, nhưng có sự thay đổi tuần hoàn của các tính chất hóa học khi di chuyển theo chiều ngang. Các nguyên tố trong cùng một nhóm thường có các tính chất hóa học tương đồng, do có cùng số electron hóa trị.
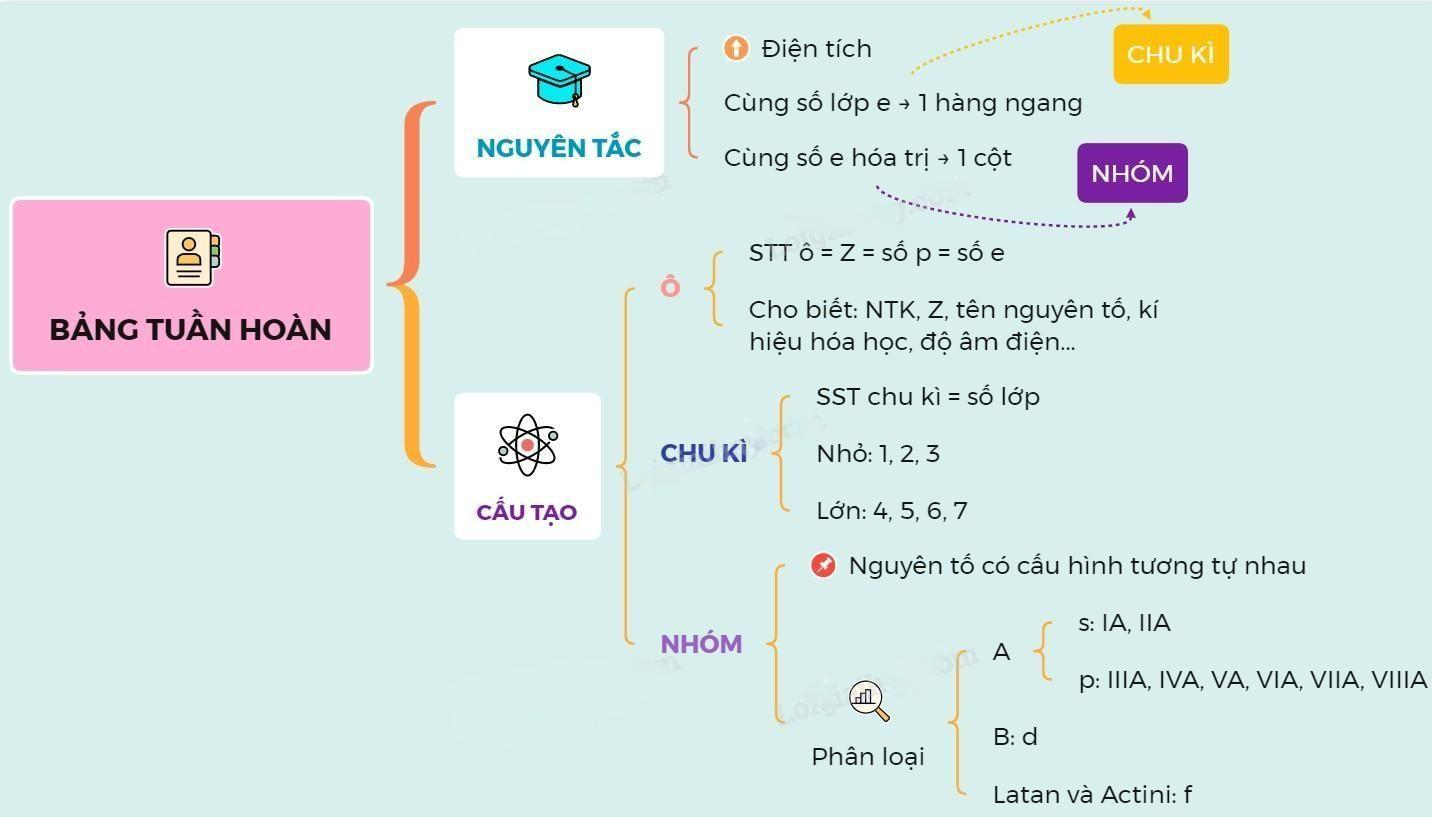
Nguyên tắc 1
Các nguyên tố được sắp xếp theo chiều tăng dần của số hiệu nguyên tử (Z), tức là số proton trong hạt nhân.
Số hiệu nguyên tử cũng là số thứ tự của nguyên tố trên bảng tuần hoàn.
Ví dụ, Hydro có Z = 1, Heli có Z = 2, v.v.
Nguyên tắc 2
Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng ngang, gọi là chu kỳ. Có bảy chu kỳ trong bảng tuần hoàn, được đánh số từ 1 đến 7.
Số chu kỳ bằng số lớp electron lớn nhất của nguyên tố. Ví dụ, Carbon có 2 lớp electron, nên nó thuộc chu kỳ 2. Uranium có 7 lớp electron, nên nó thuộc chu kỳ 7.
Nguyên tắc 3
Các nguyên tố có cùng số electron hóa trị (số electron ở lớp ngoài cùng) trong nguyên tử được xếp thành một cột dọc, gọi là nhóm. Có 18 nhóm trong bảng tuần hoàn, được đánh số từ 1 đến 18. Số nhóm bằng số electron hóa trị của nguyên tố, trừ nhóm 0 (nhóm 18) có 8 electron hóa trị.
Ví dụ: Natri có 1 electron hóa trị, nên nó thuộc nhóm 1. Oxi có 6 electron hóa trị, nên nó thuộc nhóm 16.
Một số tranh luận xung quanh bảng tuần hoàn
Bảng tuần hoàn là một công cụ quan trọng trong hóa học, nhưng nó cũng gặp một số tranh luận và thách thức về cách bố trí, phân loại, và mở rộng các nguyên tố hóa học.
Vị trí của hydro: Hydro là nguyên tố đầu tiên trong bảng tuần hoàn, nhưng nó có thể được xếp vào nhiều nhóm khác nhau, tùy thuộc vào tính chất hóa học của nó.
Hydro có thể được xem như là một kim loại kiềm (nhóm 1), một halogen (nhóm 17), hoặc một nguyên tố riêng biệt. Một số bảng tuần hoàn có thể để lại một ô trống cho hydro ở nhóm 1, hoặc đặt nó ở hai vị trí khác nhau.
Vị trí của heli: Heli là nguyên tố thứ hai trong bảng tuần hoàn, và thường được xếp vào nhóm 18, là nhóm các khí hiếm.
Tuy nhiên, một số nhà khoa học cho rằng heli nên được xếp vào nhóm 2, là nhóm các kim loại kiềm thổ, vì nó có cùng cấu hình electron với các nguyên tố này. Hơn nữa, heli có thể tạo thành các hợp chất với các nguyên tố khác, giống như các kim loại kiềm thổ
Vị trí của lantan và actini: Lantan và actini là hai nhóm các nguyên tố có cấu hình electron d và f, thường được gọi là các nguyên tố chuyển tiếp và các nguyên tố chuyển tiếp nội.
Các nguyên tố này thường được tách ra khỏi bảng tuần hoàn chính, và được đặt ở dưới cùng, để giảm chiều rộng của bảng. Tuy nhiên, một số nhà khoa học cho rằng cách bố trí này làm mất đi sự liên kết giữa các nguyên tố này với các nguyên tố khác trong cùng chu kỳ.
Một số bảng tuần hoàn có thể đặt các nguyên tố này vào bảng chính, hoặc sử dụng các hình dạng khác nhau để thể hiện sự liên quan của chúng
Vị trí của các nguyên tố mới: Các nguyên tố mới là các nguyên tố có số hiệu nguyên tử lớn hơn 118, chưa được phát hiện hoặc tổng hợp được. Người ta hiện vẫn đang nghiên cứu và thử nghiệm để tạo ra các nguyên tố này, nhưng cũng gặp nhiều khó khăn về kỹ thuật và lý thuyết.
Nếu các nguyên tố mới được tạo ra, sẽ có nhiều tranh luận về cách đặt tên, phân loại, và xếp vị trí cho chúng trong bảng tuần hoàn.
Có thể sẽ cần phải tạo ra các chu kỳ và nhóm mới, hoặc thay đổi cấu trúc của bảng tuần hoàn
Kết nối với chúng tôi
Bảng Tuần Hoàn
Theo dõi chúng tôi trên các nền tảng như Facebook, Twitter, và Instagram để không bỏ lỡ bất kỳ bài viết, hình ảnh, hoặc video nào mới nhất.
Bằng cách tham gia và tương tác với chúng tôi trên các kênh này, bạn sẽ được cập nhật thông tin mới nhất và có cơ hội giao lưu, trao đổi ý kiến với cộng đồng của chúng tôi.
Lời cảm ơn
Cảm ơn bạn đã chọn trang web của chúng tôi để tìm hiểu về bảng tuần hoàn hoá học lớp 7,8,9,10. Trang web này cung cấp cho bạn định nghĩa, cấu tạo và tầm quan trọng của bảng tuần hoàn hoá học khi học hoá học. Bảng tuần hoàn hoá học là một công cụ quan trọng giúp bạn phân loại và so sánh các nguyên tố hoá học theo các đặc tính và tính chất của chúng.
Bảng tuần hoàn hóa học lớp 10 trang bao nhiêu?
Bảng tuần hoàn hóa học lớp 10 nằm ở trang 38 của sách giáo khoa hóa học lớp 10. Nằm sau bài giới thiệu đôi nét về Dimitri Mendeleev người phát minh ra bảng tuần hoàn và lý lẽ mà ông tạo ra nó.
Bảng tuần hoàn các nguyên tố hóa học có bao nhiêu nguyên tố?
Bảng tuần hoàn hiện nay có 118 nguyên tố được xác nhận, trong đó 94 nguyên tố tự nhiên và 24 nguyên tố nhân tạo. Các nguyên tố được chia thành các nhóm và chu kỳ dựa trên các tính chất hóa học và vật lý của chúng.
Hàng ngang trong bảng tuần hoàn các nguyên tố hóa học còn gọi là gì?
Hàng ngang trong bảng tuần hoàn các nguyên tố hóa học còn gọi là chu kỳ. Mỗi chu kỳ chứa các nguyên tố có cấu hình electron tương tự nhau trong lớp ngoài cùng. Số lượng nguyên tố trong mỗi chu kỳ tăng dần từ trên xuống dưới. Có tất cả bảy chu kỳ trong bảng tuần hoàn hiện đại.
Bảng tuần hoàn hóa học đầu tiên có bao nhiêu nguyên tố?
Bảng tuần hoàn hóa học đầu tiên được công bố vào năm 1869 bởi nhà hóa học người Nga Dmitri Mendeleev. Bảng này bao gồm 63 nguyên tố được sắp xếp theo trọng lượng nguyên tử và tính chất hóa học. Bảng tuần hoàn hóa học đầu tiên đã mở ra một kỷ nguyên mới trong lịch sử khoa học, khi cho phép dự đoán sự tồn tại và đặc điểm của các nguyên tố chưa được khám phá.