Hóa trị của clo là số liên kết hóa học mà nguyên tố này có thể tạo ra với các nguyên tố khác. Hóa trị của clo có thể thay đổi tùy thuộc vào điều kiện của phản ứng và tính chất của các chất tham gia. Hóa trị của clo quan trọng trong hóa học vì nó ảnh hưởng đến cấu trúc, tính chất và phản ứng của các hợp chất có chứa clo.
Trong bài viết này, chúng ta sẽ tìm hiểu về các giá trị hóa trị khác nhau của clo và các thông tin liên quan về nguyên tố Cl (Clo) nhé!
Cl hoá trị mấy
Trong bảng tuần hoàn hóa học, Clo là nguyên tố có ký hiệu Cl với số hiệu nguyên tử là 17. Đây là nguyên tố phi kim, thuộc nhóm halogen, chu kỳ 3 ở ô số 17. Clo tồn tại dưới dạng Cl2 với hóa trị là I. Ở trạng thái phân tử, khối lượng nguyên tử của Clo là 71.
Các tính chất của Clo
Tính chất vật lý
Dưới dạng phân tử, nó thường xuất hiện dưới dạng khí màu vàng nhạt, có mùi khá đặc trưng và độc. Dưới điều kiện tiêu chuẩn, clo là một chất lỏng không màu và không mùi.
Clo tồn tại ở dạng phân tử hai nguyên tử Cl2, là một chất khí màu vàng lục, có mùi hắc và độc hại. Clo nặng hơn không khí khoảng 2,5 lần, tan vừa phải trong nước và nhiều trong các dung môi hữu cơ.
Clo có độ âm điện cao nhất trong các nguyên tố và có độ âm điện đứng thứ ba sau flo và oxy. Clo có khả năng oxi hóa mạnh, tác dụng với hầu hết các kim loại và phi kim, tạo thành các muối halogenua.
Clo cũng có thể có các trạng thái oxy hóa khác nhau (-1, 0, +1, +3, +5, +7), trong các hợp chất với flo hoặc oxy.
Nhiệt độ nóng chảy của clo là -101,5 °C, nhiệt độ sôi là -34,04 °C. Cấu trúc tinh thể của clo ở thể rắn là trực thoi.

Bài viết này được đăng lần đầu tiên trên website Bảng tuần hoàn hóa học. Mọi trang web khác sử dụng nội dung này đều là copy!
Tính chất hoá học
Clo có tính khử mạnh và là một chất oxy hóa mạnh. Nó có thể phản ứng với nhiều loại kim loại và hợp chất hữu cơ, thường tạo ra các hợp chất clo hóa. Ví dụ, clo có thể oxi hóa axit hydrocloric (HCl) thành clo (Cl₂). Ngoài ra, clo cũng có thể phản ứng với nước để tạo ra axit clohydric (HClO) và axit clohydric (HClO₃).
Clo cũng có thể tạo ra các hợp chất halogen dễ bay hơi, như triclorua clo (Cl₃). Đồng thời, nó cũng được sử dụng rộng rãi trong xử lý nước để diệt khuẩn và làm sạch do khả năng diệt khuẩn mạnh mẽ của nó. Tuy nhiên, sử dụng clo cần phải cẩn thận do tính độc hại của nó.
Clo có đồng vị không?
Theo bảng tuần hoàn các nguyên tố, clo có số nguyên tử là 17 và số khối trung bình là 35,453. Điều này có nghĩa là clo có hai đồng vị ổn định là Cl-35 và Cl-37, chiếm tỉ lệ phần trăm khối lượng lần lượt là 75,77% và 24,23%.
Ngoài ra, clo còn có 24 đồng vị không ổn định (hay còn gọi là đồng vị phóng xạ), trong đó Cl-36 là đồng vị có chu kỳ bán rã dài nhất (khoảng 3×10^5 năm), còn các đồng vị khác thường có chu kỳ bán rã rất ngắn (từ vài giây đến vài phút).
Có một số phương pháp được sử dụng để phân biệt các đồng vị của clo, chủ yếu dựa vào sự khác biệt về khối lượng và tính phóng xạ của chúng.
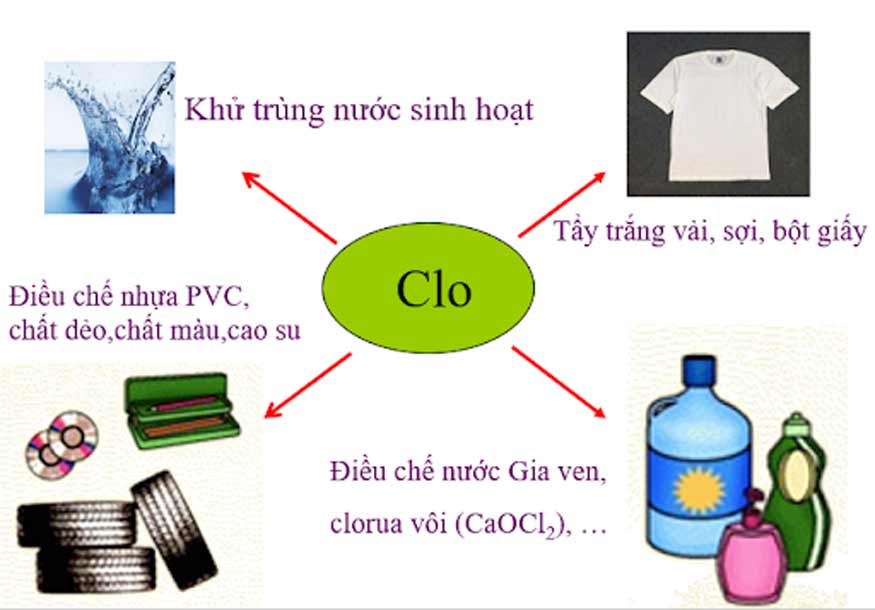
Các ứng dụng của Clo
Clo là một nguyên tố quan trọng trong tự nhiên và trong công nghiệp. Clo là một thành phần của muối ăn (NaCl) và nước biển. Clo cũng là một chất cần thiết cho sự sống của nhiều loài thực vật và động vật, bao gồm cả con người. Clo tham gia vào quá trình tiêu hóa, diệt khuẩn và duy trì cân bằng acid-baz trong cơ thể.
Clo cũng có nhiều ứng dụng trong sản xuất và đời sống, cụ thể như sau:
- Sử dụng như một chất sát trùng trong công nghiệp xử lý nước thải và nước sinh hoạt. Clo có thể diệt khuẩn, vi khuẩn, virus và nấm mốc hiệu quả, giúp giảm nguy cơ lây nhiễm bệnh. Clo cũng được dùng để khử trùng nước bể bơi, giữ cho nước trong sạch và an toàn cho người tắm.
- Tẩy trắng các loại sợi, giấy và vải. Clo có thể phá vỡ các liên kết màu sắc của các chất hữu cơ, làm cho chúng trắng sáng hơn. Clo cũng có thể loại bỏ các chất bẩn và mùi hôi trên các vật liệu này.
- Là nguyên liệu trong quy trình sản xuất nhiều hợp chất hữu cơ và vô cơ, có ý nghĩa to lớn trong công nghiệp. Ví dụ như: axit clohidric (HCl), axit clo sulfuric (H2SO4), clorua vôi (Ca(ClO)2), cloramin (NH2Cl), clo benzen (C6H5Cl), clo hexan (C6H11Cl), clo metan (CH3Cl), cloroform (CHCl3), vinyl clorua (C2H3Cl), polyvinyl clorua (PVC), clorofluorocacbon (CFC)…
- Điều chế clo trong phòng thí nghiệm hoặc công nghiệp. Có nhiều phương pháp để điều chế clo, nhưng phổ biến nhất là phương pháp điện phân dung dịch muối ăn (NaCl). Khi điện phân dung dịch NaCl, ở điện cực âm sẽ sinh ra khí hidro (H2), còn ở điện cực dương sẽ sinh ra khí clo (Cl2). Khí clo sau đó được thu gom và xử lý theo mục đích sử dụng.
ung-dung-cua-clo
Clo là một nguyên tố hoá học có vai trò quan trọng trong nhiều lĩnh vực của cuộc sống. Tuy nhiên, clo cũng có thể gây hại cho sức khỏe và môi trường nếu không được sử dụng đúng cách. Clo có thể gây kích ứng da, mắt, hô hấp và tiêu hóa.
Clo cũng có thể gây ô nhiễm không khí, nước và đất, ảnh hưởng đến sự sống của các sinh vật. Clo cũng có thể phá hủy tầng ozone bảo vệ Trái Đất khỏi bức xạ cực tím. Do đó, khi sử dụng clo, cần phải tuân thủ các quy định an toàn và bảo vệ môi trường.