Việc hiểu và sử dụng bảng tuần hoàn hoá học là một kỹ năng cơ bản đối với những ai đam mê và học về hóa học. Bảng tuần hoàn không chỉ là một bảng gồm các yếu tố hóa học được sắp xếp theo thứ tự nguyên tử, mà còn là một công cụ mạnh mẽ giúp ta hiểu sâu hơn về tính chất và mối quan hệ giữa các nguyên tố
Bằng cách đọc bảng tuần hoàn, bạn có thể dự đoán được phản ứng và liên kết của các nguyên tố với nhau, cũng như biết được vai trò của chúng trong tự nhiên và cuộc sống.
Cách đọc bảng tuần hoàn hoá học
Bảng tuần hoàn được sắp xếp theo thứ tự tăng dần của số nguyên tử, tức là số proton trong nhân nguyên tử. Mỗi nguyên tố được biểu diễn bằng một ký hiệu gồm một hoặc hai chữ cái, ví dụ H là hidro, O là oxy, Fe là sắt. Mỗi nguyên tố còn có một số khối, tức là trung bình của khối lượng các đồng vị của nó.
Cấu trúc bảng tuần hoàn
Bảng tuần hoàn được chia thành bảy hàng ngang gọi là chu kỳ (7 chu kỳ) và 18 cột dọc gọi là nhóm (18 nhóm). Các nguyên tố trong cùng một chu kỳ có cùng số lớp electron, còn các nguyên tố trong cùng một nhóm có cùng số electron ở lớp ngoài cùng.
Số electron ở lớp ngoài cùng quyết định tính chất hoá học của nguyên tố, ví dụ khả năng liên kết với các nguyên tố khác hay phản ứng với các chất khác.
Bài viết này được đăng lần đầu tiên trên website Bảng tuần hoàn hóa học. Mọi trang web khác sử dụng nội dung này đều là copy!

Các nhóm nguyên tố đặc biệt
Có một số nhóm đặc biệt trong bảng tuần hoàn, ví dụ nhóm 1 gọi là kim loại kiềm, nhóm 2 gọi là kim loại kiềm thổ, nhóm 17 gọi là halogen, nhóm 18 gọi là khí trơ.
Các nguyên tố trong những nhóm này có những tính chất hoá học rất đặc trưng và dễ nhận biết. Ví dụ, kim loại kiềm rất mềm và có thể bị cắt bằng dao, halogen rất phản ứng và có thể tạo ra muối khi kết hợp với kim loại kiềm, khí trơ rất ít phản ứng và thường được dùng để bảo quản các chất khác.
Ngoài ra, bảng tuần hoàn còn có hai dãy ngang riêng biệt gọi là lantanit và actinit. Các nguyên tố này có số lớp electron nhiều hơn các nguyên tố khác và có tính chất hoá học phức tạp hơn. Các nguyên tố này thường được dùng trong các lĩnh vực khoa học cao cấp, ví dụ y học hạt nhân, vật liệu mới, năng lượng hạt nhân.
Các thông số trên một nguyên tố
Để đọc bảng tuần hoàn nguyên tố hoá học, ta cần nắm rõ các thông tin cơ bản về từng nguyên tố, ví dụ số nguyên tử, số khối, ký hiệu, số electron ở lớp ngoài cùng. Ta cũng cần hiểu được sự liên quan giữa vị trí của nguyên tố trong bảng tuần hoàn và tính chất hoá học của nó.
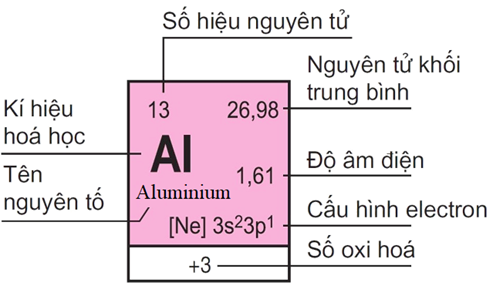
Tên nguyên tố
Là tên gọi của một loại nguyên tử có cùng số proton trong hạt nhân. Tên nguyên tố thường bắt nguồn từ tiếng Latinh, tiếng Hy Lạp, tiếng Ả Rập hoặc địa danh. Ví dụ: Oxy (tiếng Latinh oxygenium), Nitơ (tiếng Hy Lạp nitrogen), Bor (tiếng Ả Rập buraq), Nhôm (địa danh Alumina).
Ký hiệu hoá học
Là ký hiệu viết tắt của tên nguyên tố bằng chữ cái Latinh. Ký hiệu hoá học thường gồm một hoặc hai chữ cái, trong đó chữ cái đầu được viết hoa và chữ cái sau được viết thường. Ví dụ: O (Oxy), N (Nitơ), B (Bor), Al (Nhôm).
Số hiệu nguyên tử
Là số proton trong hạt nhân của một nguyên tử. Số hiệu nguyên tử được ký hiệu bằng chữ Z và được viết ở trên bên trái của ký hiệu hoá học. Ví dụ: 😯 (Oxy có 8 proton), 7N (Nitơ có 7 proton), 5B (Bor có 5 proton), 13Al (Nhôm có 13 proton).
Nguyên tử khối
Là khối lượng của một nguyên tử, được tính bằng tổng số proton và nơtron trong hạt nhân. Nguyên tử khối được ký hiệu bằng chữ A và được viết ở trên bên phải của ký hiệu hoá học. Nguyên tử khối thường được tính bằng đơn vị u (đơn vị khối lượng nguyên tử) hoặc g/mol (gam trên mol).
Ví dụ: 16O (Oxy có nguyên tử khối là 16 u hoặc 16 g/mol), 14N (Nitơ có nguyên tử khối là 14 u hoặc 14 g/mol), 11B (Bor có nguyên tử khối là 11 u hoặc 11 g/mol), 27Al (Nhôm có nguyên tử khối là 27 u hoặc 27 g/mol).

Độ âm điện
Là độ mạnh yếu của sự hút electron của một nguyên tử khi tham gia liên kết với một nguyên tử khác. Độ âm điện được ký hiệu bằng chữ X và được đo bằng thang Pauling từ 0 đến 4. Càng gần số 4 thì càng có độ âm điện cao, càng gần số 0 thì càng có độ âm điện thấp.
Ví dụ: XO = 3,44 (Oxy có độ âm điện cao nhất trong các nguyên tố), XN = 3,04 (Nitơ có độ âm điện cao thứ hai trong các nguyên tố), XB = 2,04 (Bor có độ âm điện trung bình trong các nguyên tố), XAl = 1,61 (Nhôm có độ âm điện thấp trong các nguyên tố).
Cấu hình electron
Là cách sắp xếp của các electron trong các vỏ nguyên tử của một nguyên tử. Cấu hình electron được ký hiệu bằng các số lượng electron ở mỗi vỏ, theo thứ tự từ vỏ trong ra vỏ ngoài, cách nhau bởi dấu chấm.
Ví dụ: O (2.6) (Oxy có 2 electron ở vỏ trong và 6 electron ở vỏ ngoài), N (2.5) (Nitơ có 2 electron ở vỏ trong và 5 electron ở vỏ ngoài), B (2.3) (Bor có 2 electron ở vỏ trong và 3 electron ở vỏ ngoài), Al (2.8.3) (Nhôm có 2 electron ở vỏ trong, 8 electron ở vỏ giữa và 3 electron ở vỏ ngoài).
Số oxi hoá
Là số đo sự thay đổi số electron của một nguyên tử khi tham gia phản ứng hoá học. Số oxi hoá được ký hiệu bằng chữ R và được viết dưới bên phải của ký hiệu hoá học, có dấu cộng hoặc trừ tùy theo nguyên tử nhận hay nhường electron.
Ví dụ: O-2 (Oxy có số oxi hoá là -2, nghĩa là nhận thêm 2 electron), N+5 (Nitơ có số oxi hoá là +5, nghĩa là nhường đi 5 electron), B+3 (Bor có số oxi hoá là +3, nghĩa là nhường đi 3 electron), Al+3 (Nhôm có số oxi hoá là +3, nghĩa là nhường đi 3 electron).
Mẹo ghi nhớ bảng tuần hoàn hay nhất
Bảng tuần hoàn là một công cụ hữu ích để biết các nguyên tố hóa học và tính chất của chúng. Tuy nhiên, việc nhớ tên và thứ tự của 118 nguyên tố không phải là dễ dàng.
Sử dụng các câu chuyện, bài hát, thơ hoặc ký hiệu để ghi nhớ các nguyên tố theo nhóm, chu kỳ hoặc tính chất.
Sử dụng các phương pháp ghi nhớ dựa trên hình ảnh, màu sắc hoặc ký tự. Ví dụ: bạn có thể vẽ các hình minh họa cho các nguyên tố và liên kết chúng với tên hoặc ký hiệu của chúng, hoặc sử dụng các màu khác nhau để phân biệt các nhóm nguyên tố trên bảng tuần hoàn, hoặc sử dụng các ký tự đặc biệt để đại diện cho các số hạt nhân của các nguyên tố.
Luyện tập thường xuyên bằng cách sử dụng các bài kiểm tra, trò chơi, ứng dụng hoặc flashcard. Ví dụ: bạn có thể tải về các ứng dụng như Periodic Table Quiz, Periodic Table Game hoặc Periodic Table Flashcards để kiểm tra kiến thức của mình về bảng tuần hoàn, hoặc bạn có thể in ra các flashcard với tên, ký hiệu, số nguyên tử và số khối của các nguyên tố và lật chúng để ôn tập.
Bài ca hoá trị 1
Hidro (H) cùng với liti (Li)
Natri (Na) cùng với kali (K) chẳng rời
Ngoài ra còn bạc (Ag) sáng ngời
Chỉ mang hoá trị I thôi chớ nhầm
Riêng đồng (Cu) cùng với thuỷ ngân (Hg)
Thường II ít I chớ phân vân gì
Đổi thay II , IV là chì (Pb)
Điển hình hoá trị của chì là II
Bao giờ cùng hoá trị II
Là ôxi (O) , kẽm(Zn) chẳng sai chút gì
Ngoài ra còn có canxi (Ca)
Magiê (Mg) cùng với bari (Ba) một nhà
Bo (B) , nhôm (Al) thì hóa trị III
Cácbon © silic (Si) thiếc (Sn) là IV thôi
Thế nhưng phải nói thêm lời
Hóa trị II vẫn là nơi đi về
Sắt (Fe) II toan tính bộn bề
Không bền nên dễ biến liền sắt III
Phốtpho III ít gặp mà
Photpho V chính người ta gặp nhiều
Nitơ (N) hoá trị bao nhiêu ?
I , II, III , IV phần nhiều tới V
Lưu huynh lắm lúc chơi khăm
Khi II lúc IV , VI tăng tột cùng
Clo Iot lung tung
II III V VII thường thì I thôi
Mangan rắc rối nhất đời
Đổi từ I đến VII thời mới yên
Hoá trị II dùng rất nhiều
Hoá trị VII cũng được yêu hay cần
Bài ca hoá trị thuộc lòng
Viết thông công thức đề phòng lãng quên
Học hành cố gắng cần chuyên
Siêng ôn chăm luyện tất nhiên nhớ nhiều
Bài ca nguyên tử khối
Hai ba Natri (Na=23)
Nhớ ghi cho rõ
Kali chẳng khó
Ba chín dễ dàng (K=39)
Khi nhắc đến Vàng
Một trăm chín bảy (Au=197)
Oxi gây cháy
Chỉ mười sáu thôi (O=16)
Còn Bạc dễ rồi
Một trăm lẻ tám (Ag =108)
Sắt màu trắng xám
Năm sáu có gì (Fe=56)
Nghĩ tới Beri
Nhớ ngay là chín (Be=9)
Gấp ba lần chín
Là của anh Nhôm (Al=27)
Còn của Crôm
Là năm hai đó (Cr=52)
Của Đồng đã rõ
Là sáu mươi tư (Cu =64)
Photpho không dư
Là ba mươi mốt (P=31)
Hai trăm lẻ một
Là của Thủy Ngân (Hg=201)
Chẳng phải ngại ngần
Nitơ mười bốn (N=14)
Hai lần mười bốn
Silic phi kim (Si=28)
Can xi dễ tìm
Bốn mươi vừa chẵn (Ca=40) Mangan vừa vặn
Con số năm lăm (Mn=55)
Ba lăm phẩy năm
Clo chất khí (Cl=35.5)
Phải nhớ cho kỹ
Kẽm là sáu lăm (Zn=65)
Lưu huỳnh chơi khăm
Ba hai đã rõ (S=32)
Chẳng có gì khó
Cacbon mười hai (C=12)
Bari hơi dài
Một trăm ba bảy (Ba=137)
Phát nổ khi cháy
Cẩn thận vẫn hơn
Khối lượng giản đơn
Hiđrô là một (H=1)
Còn cậu Iốt
Ai hỏi nói ngay
Một trăm hai bảy (I=127)
Nếu hai lẻ bảy
Lại của anh Chì (Pb =207)
Brôm nhớ ghi
Tám mươi đã tỏ (Br = 80)
Nhưng vẫn còn đó
Magiê hai tư (Mg=24)
Chẳng phải chần trừ
Flo mười chín (F=19).
Bài ca kí hiệu hoá học
Ca là chú Can xi
Ba là cậu Bari họ hàng
Au tên gọi là Vàng
Ag là Bạc cùng làng với nhau
Viết Đồng C trước u sau
Pb mà đứng cùng nhau là Chì
Al đấy tên gì?
Gọi Nhôm bác sẽ cười khì mà xem
Cacbon vốn tính nhọ nhem
Kí hiệu C đó bạn đem nhóm lò
Oxy O đấy lò dò
Gặp nhau hai bạn cùng hò cháy to
Cl là chú Clo
Lưu huỳnh em nhớ viết cho S (ét sờ).
Zn là Kẽm khó gì
Na gọi Natri học hàng
Br thật rõ ràng
Brom “người ấy” cùng làng Gari (Ga)
Fe chẳng khó chi
Gọi tên là sắt em ghi ngay vào
Hg chẳng khó tí nào
Thuỷ ngân em đọc tự hào chẳng sai
…
Bài ca nhắc bạn xa gần
Học chăm để nhớ khi cần viết ra.
Lời kết
Để đọc bảng tuần hoàn hoá học, bạn cần nắm được các thông tin cơ bản về các nguyên tố, như ký hiệu, số nguyên tử, số khối và nhóm.
Bạn cũng cần biết cách phân biệt các loại nguyên tố khác nhau dựa trên vị trí của chúng trên bảng. Bảng tuần hoàn hoá học là một công cụ hữu ích cho việc học tập và nghiên cứu về hoá học.
Bằng cách nắm vững cách đọc bảng tuần hoàn, bạn có thể dễ dàng tìm ra các tính chất và mối quan hệ của các nguyên tố.