Hóa trị của một nguyên tố hóa học như một chiếc chìa khóa vạn năng giúp bạn có thể khám phá nhiều điều thú vị từ nó. Điển hình như nito là một nguyên tố quen thuộc nhưng liệu bạn có biết N hóa trị mấy không? Thay vì vẫn thắc mắc thì chúng ta cùng đi tìm hiểu hóa trị của nito và khám phá tất tần về nó nhé!
N là gì?
N là ký hiệu của nguyên tố hóa học nito. Nito thường được biểu hiện dưới dạng phân tử là N2. Trong bảng tuần hoàn các nguyên tố hoá học, N nằm ở vị trí thứ 7, chu kỳ 2 và nhóm VA.

Bài viết này được đăng lần đầu tiên trên website Bảng tuần hoàn hóa học. Mọi trang web khác sử dụng nội dung này đều là copy!
Trong không khí, nito chiếm khoảng 78% và nó đóng vai trò quan trọng trong việc ngăn cản bức xạ, đảm bảo an toàn cho trái đất. Bên cạnh đó, N cũng góp mặt trong cac quá trình sinh học cũng như ngành công nghiệp.
N hóa trị mấy?
Nito có nhiều hoá trị khác nhau. Hoá trị của nito là II, III, IV,… Nó có thể linh hoạt trong việc kết hợp với các nguyên tố khác. Điều này có nghĩa là nito có thể tạo ra các hợp chất khác nhau bằng cách nhận hoặc nhường các điện tử với các nguyên tố khác trong các trạng thái oxi hóa khác nhau.

Ví dụ: Trong hợp chất NH3, nito có hóa trị -III, trong hợp chất NO, nito có hóa trị +II, trong hợp chất N2O4, nito có hóa trị +IV. Các hóa trị này phản ánh khả năng của nito để tương tác với các nguyên tố khác và tạo ra các liên kết hóa học khác nhau trong các hợp chất.
Ngoài ra, nito cũng có thể xuất hiện ở các hóa trị khác như V, VI, tùy thuộc vào điều kiện và môi trường phản ứng cụ thể.
Cấu tạo phân tử của Nitơ
Nito có cấu trúc 2 electron 2 lớp. Trong đó, lớp ngoài cùng của N chứa 5 electron hoạt động. Cấu hình electron của khí N2 là 1s^{2}2s^{2}2p^{3} và chỉ số oxi hoá của chúng lần lượt sẽ là -3, 0, +1, +2, +3, +4, +5. Nó được xem là một phi kim hoạt động mạnh.
Phân tử của khí nito sẽ bao gồm 2 nguyên tử N liên kết 3 với khoảng cách giữa hai nguyên tử là 109,76 pm.
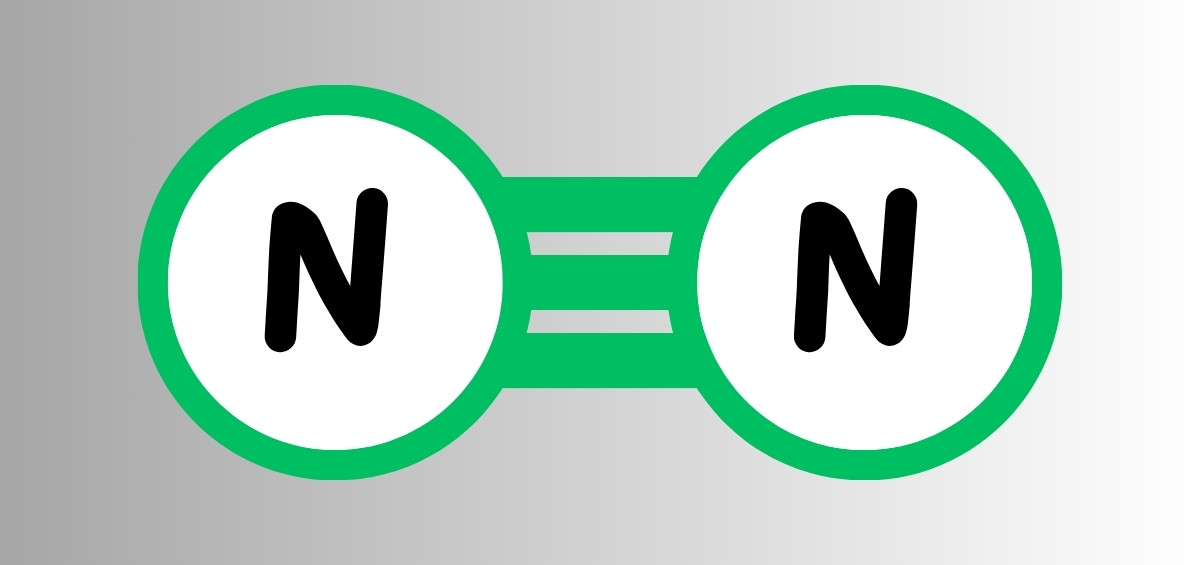
Tính chất của nito
Tính chất vật lý
Tính chất vật lý của nito được thể hiện như sau:
- Là khí không có màu, không mùi, không vị.
- Khối lượng riêng của nito nhẹ hơn không khí, d = 28/29.
- Ít tan trong nước, tan ở -196 độ C.
- Hoá rắn ở nhiệt độ cực thấp.
- Không có khả năng duy trì sự cháy.
- Không tham gia vào quá trình hô hấp.

Tính chất hóa học
Dưới đây là tính chất hoá học của nito:
Có số oxi hoá đa dạng
Nitơ có các số oxi hoá: -3, 0, +1, +2, +3, +4, +5. N2 (phân tử nitơ) có số oxi hoá là 0, thể hiện tính oxi hoá và tính khử.
Độ âm điện và tính chất ở nhiệt độ cao
Độ âm điện của Nitơ (EN N) là 946 kJ/mol. Nitơ ở nhiệt độ thường có tính chất hóa học trơ, nhưng tăng động ở nhiệt độ cao.
Tính oxi hóa và các phản ứng
- Tác dụng với hidro: Ở nhiệt độ cao, áp suất cao và có xúc tác, nitơ phản ứng với hidro tạo amoniac: N2 + 3H2 → 2NH3 (delta H = -92, phản ứng thuận nghịch).
- Tác dụng với kim loại: Nitơ tác dụng với liti tạo liti nitrua: 6Li + N2 → 2Li3N. Ở nhiệt độ cao, nitơ tác dụng với Magiê tạo magie nitrua: 3Mg + N2 → Mg3N2.
Chú ý: Nitơ chỉ thể hiện tính oxi hóa với nguyên tố có độ âm điện nhỏ hơn.
Tính khử và các phản ứng
Nitơ thể hiện tính khử khi kết hợp với nguyên tố có độ âm điện lớn hơn. Ở nhiệt độ khoảng 3000ºC, nitơ tác dụng với oxi tạo nitơ monoxit. Ở điều kiện thường, nitơ monoxit tác dụng với oxi tạo nitơ đioxit, màu nâu đỏ.
Ngoài ra, nitơ tạo ra một số oxit khác như N2O, N2O3, N2O5, nhưng không được điều chế trực tiếp từ oxi và nitơ.
Điều chế nito
Nitơ được điều chế thông qua hai phương pháp chính là trong phòng thí nghiệm và trong công nghiệp.
Trong phòng thí nghiệm: Nitơ được tạo ra bằng cách sử dụng amoni clorua và natri nitrit, đun nóng amoni dicromat hoặc phân hủy nhiệt natri azide hoặc bari azide.

Trong công nghiệp: Nito được tạo ra bằng các phương pháp cơ học như lọc màng với áp suất và chưng cất đoạn không khí thành dạng lỏng được ưu tiên. Phương pháp này tạo ra nitơ với hiệu suất cao và chi phí thấp. Nó đáp ứng được không chỉ cho nhu cầu tại phòng thí nghiệm mà ở cả quy mô công nghiệp.
Ứng dụng của Nito trong cuộc sống
Nito được ứng dụng rộng rãi trong cuộc sống:
Trong bảo quản thực phẩm: Nito được sử dụng trong việc bảo quản thực phẩm để ngăn chặn sự oxi hoá và làm chậm thời gian phân huỷ của thực phẩm. Nó góp phần giúp cho thực phẩm được bảo quản lâu hơn, tươi ngon hơn.
Trong công nghiệp đóng chai: Nito được ứng dụng trong việc tạo ra áp suất để sản xuất chai, lon như bia hay nước ngọt. Nó giúp cho chất lỏng ở trong chai, lon không bị oxi hoá.
Trong việc làm lạnh và làm đá: Nito được sử dụng trong hệ thống làm lạnh và làm đá. Nó giúp tạo ra môi trường lạnh. Đặc biệt ứng dụng này được sử dụng nhiều trong lĩnh vực y khoa, nghiên cứu khoa học hay thực nghiệp hoá học.
Trong việc chế tạo, chế biến kim loại: Nito được ứng dụng phổ biến trong quá trình chế biến kim loại, điển hình như thép. Sử dụng nito giúp cho môi trường chế biến thép không chứa oxi, giảm tác động của oxi lên kim loại.

Trong sản xuất phân bón: Nito là thành phần chính trong phân bón, phổ biến nhất là phân ure. Nó giúp cung cấp dưỡng chất cần thiết cho cây trồng.
Trong công nghiệp điện tử: Nito được sử dụng trong công nghiệp sản xuất bán dẫn và linh kiện điện tử. Sự có mặt của nó góp phần giúp môi trường không chứa ẩm và oxi, giảm rủi ro ô nhiễm.
Trong dược học, y học: Nito được sử dụng trong lĩnh vực y học nhằm làm mát trong phẫu thuật, sản xuất các loại thuốc hay tạo ra môi trường làm việc tại các phòng thí nghiệm y khoa.
Trong chữa cháy: Nito được sử dụng trong hệ thống chữa cháy dưới dạng khí chống cháy. Nó tạo ra môi trường không chứa oxi để ngắn cháy bị lan ra.
Trong thiết bị phun sơn và in ấn: Nito được sử dụng phổ biến trong ngành công nghiệp sơn và in ấn. Nó tạo ra môi trường không bị chứa ẩm, giúp duy trì chất lượng của sản phẩm.
Những ứng dụng này thể hiện sự đa dạng và quan trọng của nitơ trong nhiều lĩnh vực khác nhau, từ đời sống hàng ngày đến công nghiệp và y học.
Bài tập tham khảo về hoá trị của nito
Câu 1
Câu hỏi: Số oxi hóa của nitơ trong NH4+, NO2- , và HNO3 lần lượt là:
A. +5, -3, +3.
B. -3, +3, +5
C. +3, -3, +5
D. +3, +5, -3.
Đáp án đúng: B. -3, +3, +5
Câu 2
Câu hỏi: Hoá trị của nito trong phân tử NH3 là?
A. 1
B. 2
C. 3
D. nhiều hoá trị
Đáp án đúng: C. 3
Câu 3
Câu hỏi: Hợp chất được cấu tạo từ nitơ (N) hoá trị II và oxi (O) hoá trị II là:
A. N2O.
B. NO.
C. NO2.
D. N2O5.
Đáp án đúng: B. NO.
Chúng tôi hy vọng rằng qua bài viết trên, bạn đã biết được đáp án cho câu hỏi N hoá trị mấy. Đồng thời, bạn cũng bổ sung cho mình thêm nhiều thông tin hữu ích về khí nito. Chúc bạn học tốt môn hoá học và đừng quên đồng hành cùng chúng tôi trong các bài viết tiếp theo nhé!